綜合新聞
高小攀博士等在Nature旗下新刊《Communications Biology》和晶體學專業期刊《IUCrJ》連續發表研究論文
進入21世紀以來,新發和突發傳染病仍然是人類面臨的最嚴重的公共衛生安全威脅之一。其中結核分枝桿菌和黃病毒科重要病毒(寨卡,阿龍山病毒……)等引發的傳染病就是其中最重要的代表。
在前期研究基礎上,崔勝課題組聯合孫義成課題組發現結核分枝桿菌一對毒素-抗毒素(Toxin-Antitoxin, TA)系統(Rv1044-Rv1045)全新作用模式,既Rv1044基因編碼一個非典型的絲氨酸蛋白激酶TakA(unusual Type of Atypical Kinase Antitoxin), Rv1045基因編碼鳥苷酰轉移酶TglT(unusual Type Guanylyltransferase-Like Toxin),其通過結合GTP發揮毒性活性,從而抑制細菌生長。而TakA具有雙重功能,一方面對(Rv1044-Rv1045)的啟動子具有自我調節抑制作用,另一方面利用ATP磷酸化TglT發揮解毒或者毒性中和作用。該研究開創了蛋白質翻譯后修飾(磷酸化)在細菌TA系統抗毒機制的全新作用模式,是結核分枝桿菌生物學特性基礎研究領域的重大原創性發現。也將為以TA為靶點的激酶抑制劑設計提供強有力的科技支撐。

圖1:結核分枝桿菌一對TA(Rv1044-Rv1045)的作用模式
基于長期從事RNA病毒解旋酶(Helicase)的研究基礎(Nature communications 2017;Science Advances 2017; Plos Pathogens 2017; Plos Pathogens 2018),崔勝課題組再次報道了分節段黃病毒科-阿龍山病毒解旋酶NS3的晶體結構,該結構為首個分節段黃病毒解旋酶的晶體結構,從而揭示了分節段和不分節段黃病毒的進化關系,也為設計廣譜的抗病毒藥物提供了精確的結構生物學基礎。
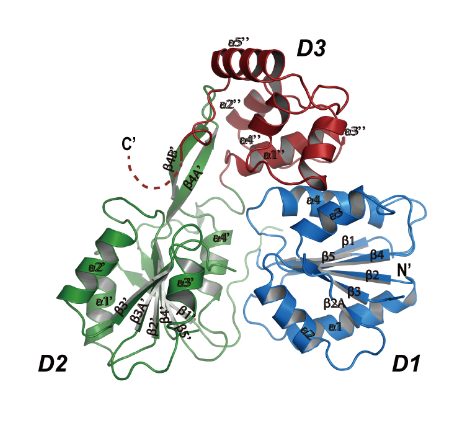
圖2:ALSV NS3解旋酶的三維晶體結構
