綜合新聞
博士研究生吳桐、主管技師朱園美等在《Frontiers in Microbiology》發表SARS-CoV-2 抑制劑LCB1耐藥情況和機制的研究論文
自新冠疫情爆發以來,人們一直致力于開發抗病毒藥物,以阻斷SARS-CoV-2生命周期的不同步驟。其中,開發能夠抑制病毒刺突蛋白(S)和人類細胞受體血管緊張素轉換酶2(ACE2)之間相互作用的病毒進入抑制劑被認為是一種很有前景的策略。LCB1是一種通過計算機設計的由56個氨基酸組成的小蛋白,以SARS-CoV-2 S蛋白受體結合域(RBD)為靶點,具有強大的體外和體內抑制活性。然而,SARS-CoV-2變異毒株的出現和快速傳播極大地影響了靶向S蛋白的疫苗和抗病毒藥物的有效性。
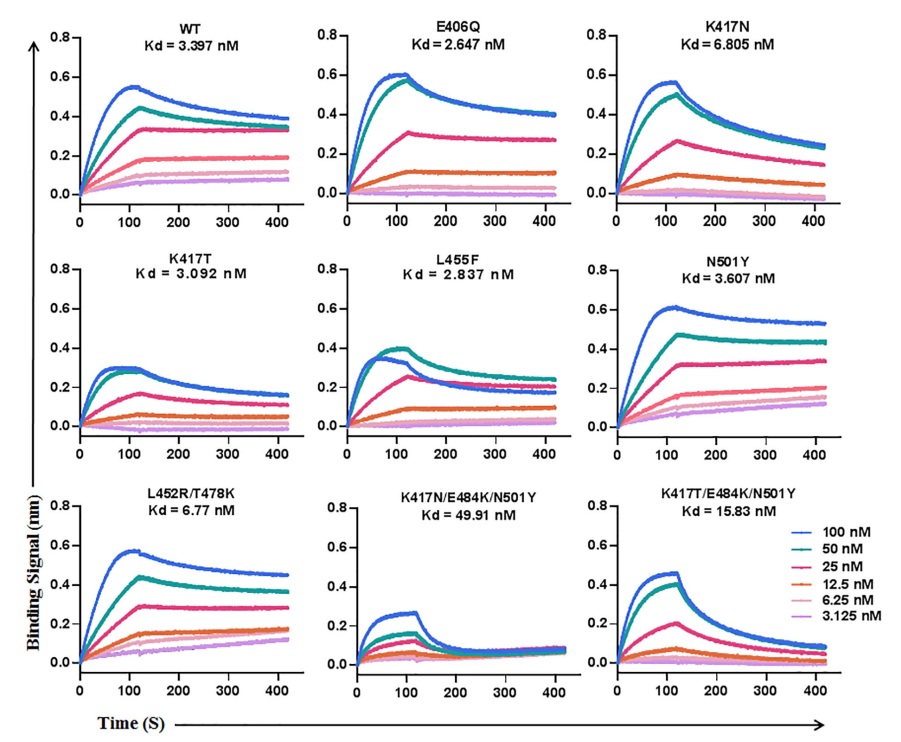
2022年10月11日,何玉先教授團隊的吳桐、朱園美等在Frontiers in Microbiology發表了題為“Resistance profifile and mechanism of severe acute respiratory syndrome coronavirus-2 variants to LCB1 inhibitor targeting the spike receptor-binding motif ”的研究論文。在本研究中,研究人員化學合成了基于肽的LCB1抑制劑,并對SARS-CoV-2變體的耐藥概況和潛在機制進行了表征。研究首先發現SARS-CoV-2關注變異株Beta、Gamma和Omicron對LCB1具有高度抗性,而Alpha和Delta對LCB1僅產生輕微抗性。隨后通過生成一組攜帶單一或組合突變的SARS-CoV-2假病毒,發現RBD中的K417N和N501Y突變在很大程度上決定了幾種VOCs的高抗性表型。此外,本研究還構建了85個SARS-CoV-2 RBD自然高頻點突變假病毒,發現E406Q、K417N和L455F對LCB1產生了高水平抗性。最后,我們發現抗性突變可以大大削弱LCB1與RBD的結合親和力,從而阻斷其對RBD與ACE2相互作用的阻斷能力。本研究為理解SARS-CoV-2對LCB1的耐藥性機制提供了重要信息并且可以指導基于LCB1的新型抗病毒藥物的設計策略,以對抗不同的SARS-CoV-2變體。
該項研究得到中國醫學科學院醫學與健康科技創新工程(2021-I2M-1037)、國家自然科學基金(82002150, 81630061)等項目的支持。何玉先教授為本文的通訊作者,博士研究生吳桐、主管技師朱園美為本文的共同第一作者。
圖. LCB1與不同突變RBD蛋白的結合親和力