綜合新聞
博士研究生邱宗林等在《AIDS》雜志發表關于HIV-1 gp41結構與功能的研究論文
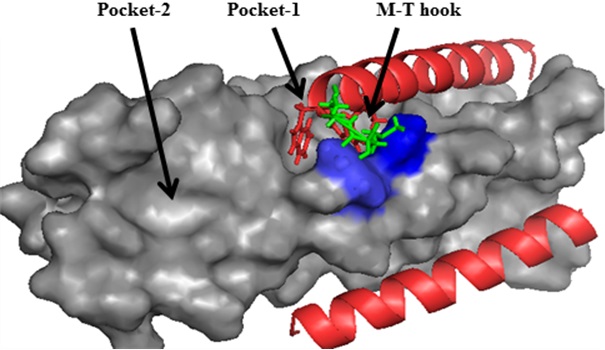
HIV-1融合蛋白 gp41介導病毒侵入宿主細胞的過程,是重要的藥物靶標,臨床應用的多肽藥物恩夫韋肽(T20)即是通過阻斷gp41介導的病毒-細胞膜融合而發揮抗病毒作用。因此,對gp41結構與功能的深入研究一直是熱點之一。近年來何玉先課題組與崔勝課題組通過合作,解析了多個HIV膜融合抑制劑和靶序列復合物的結構(J Biol Chem, 2012;FASEB J, 2013)。該論文基于前期研究所獲得的結構信息,發現位于gp41疏水深穴(Pocket-1)下游的保守序列亦形成一個獨特的相對較小的疏水深穴結構(命名為Pocket-2)。通過基因突變分析表明,位于Pocket-2中的氨基酸對gp41六聚體核心結構的穩定性以及空間構象起著關鍵的作用,亦為HIV-1感染所必需。進一步的研究發現,Pocket-2中的氨基酸突變能夠顯著影響膜融合抑制劑HP23結合pocket-1的能力,提示兩個比鄰的疏水深穴在結構上的依賴性;同時,Pocket-2的結構對gp41抑制劑的活性有著重要影響,提示其作為藥物靶點的潛在價值。該研究對HIV-1侵入機制以及抑制劑的設計具有重要的科學意義和應用價值。