綜合新聞
碩士研究生宿揚等在《Journal of Virology》再次發(fā)表關(guān)于HIV膜融合抑制劑耐藥機制的研究結(jié)果
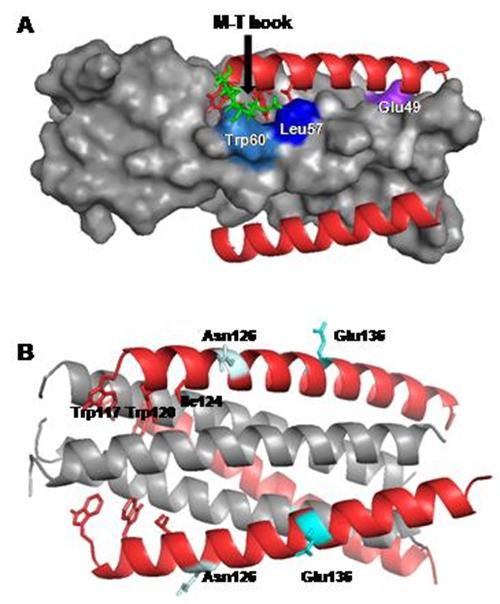
膜融合是一極其重要的生物學(xué)現(xiàn)象,比如受精卵的形成和細胞內(nèi)的囊泡運輸?shù)龋辉S多重要病毒也是通過膜融合感染宿主細胞,該過程中涉及的組分被認為具備成為藥物靶標(biāo)的潛能。T20(恩夫韋肽)是目前唯一臨床應(yīng)用的針對HIV-1膜融合的藥物,但該藥具有價格昂貴、極易誘導(dǎo)耐藥等缺點,極大地限制了它的廣泛使用。何玉先課題組多年來聚焦于病毒膜融合機制和抑制劑的研究,在多方面取得研究進展。基于M-T鉤子結(jié)構(gòu)的發(fā)現(xiàn),他們前期設(shè)計了以gp41融合蛋白疏水深穴為靶向的抗病毒短肽MTSC22和HP23(FASEB J,2013;AIDS,2015),并對模板多肽SC22EK的耐藥機制進行了探討(J Virol, 2015a)。本研究聚焦于新型抑制劑MTSC22的耐藥機制研究,該多肽含有M-T鉤子結(jié)構(gòu),對疏水深穴具有極強的結(jié)合能力。通過定點突變發(fā)現(xiàn),位于N端和C端螺旋區(qū)的多個位點與MTSC22耐藥相關(guān),尤其位于疏水深穴的L57R突變和位于C端螺旋區(qū)E136G突變是以前尚未發(fā)現(xiàn)的耐藥位點。該論文還結(jié)合多種技術(shù),對這些位點如何介導(dǎo)耐藥的分子機制進行了深入分析。上述研究對gp41的結(jié)構(gòu)與功能以及新型抗病毒藥物的設(shè)計都具有重要的科學(xué)意義和應(yīng)用價值。