綜合新聞
碩士研究生米丹和歐秀元博士等在《Journal of Virology》在線發表冠狀病毒刺突蛋白構象變化機制的最新研究成果
冠狀病毒是一類引起人類呼吸道感染的重要病原體,其中能夠導致嚴重肺炎甚至危及生命。小鼠肝炎病毒(mouse hepatitis virus, MHV)是一種最常用的模式冠狀病毒。刺突蛋白(Spike, S)是冠狀病毒的膜融合蛋白,介導病毒與受體的結合及病毒包膜與細胞膜的融合。MHV 通過S蛋白的N端結構域(NTD)結合宿主受體小鼠癌胚抗原相關細胞粘附分子1a (mCEACAM1a)后,S蛋白發生一系列構象變化進而誘導病毒膜和細胞膜融合,病毒進入宿主細胞,然而,S蛋白與受體結合后,S蛋白如何啟動構象改變并完成膜融合的過程幾乎空白。
錢朝暉課題組在研究S蛋白的相關氨基酸殘基是如何跟其受體結合的時候,意外發現在S蛋白的G29對于受體結合介導的和高pH誘導的S蛋白的構象變化至關重要。 G29位于S蛋白跟受體結合界面的邊緣和一個結構保守的turn的中心。當突變G29為Asp和Thr,從而破壞G29所在的turn時,S蛋白會發生不依賴于受體結合和pH誘導的構象變化(圖1A);但當將G29突變為Pro時,雖然保留了turn,但限制了turn的flexibility,受體結合介導和高pH誘導的S構象變化都被嚴重抑制 (圖1B)。這些結果表明G29所在的結構保守的turn及其flexibility在冠狀病毒S蛋白啟動構象變化中起著關鍵作用。最后,在G29P的基礎上,再結合CTD 結構域上Y320A突變體,發現在S蛋白構象變化過程中NTD和CTD之間的信息交流可能非常少。該研究首次發現了冠狀病毒S蛋白跟受體結合后如何啟動構象變化的重要位點,對進一步研究冠狀病毒的膜融合機制研究提供了重要的信息。
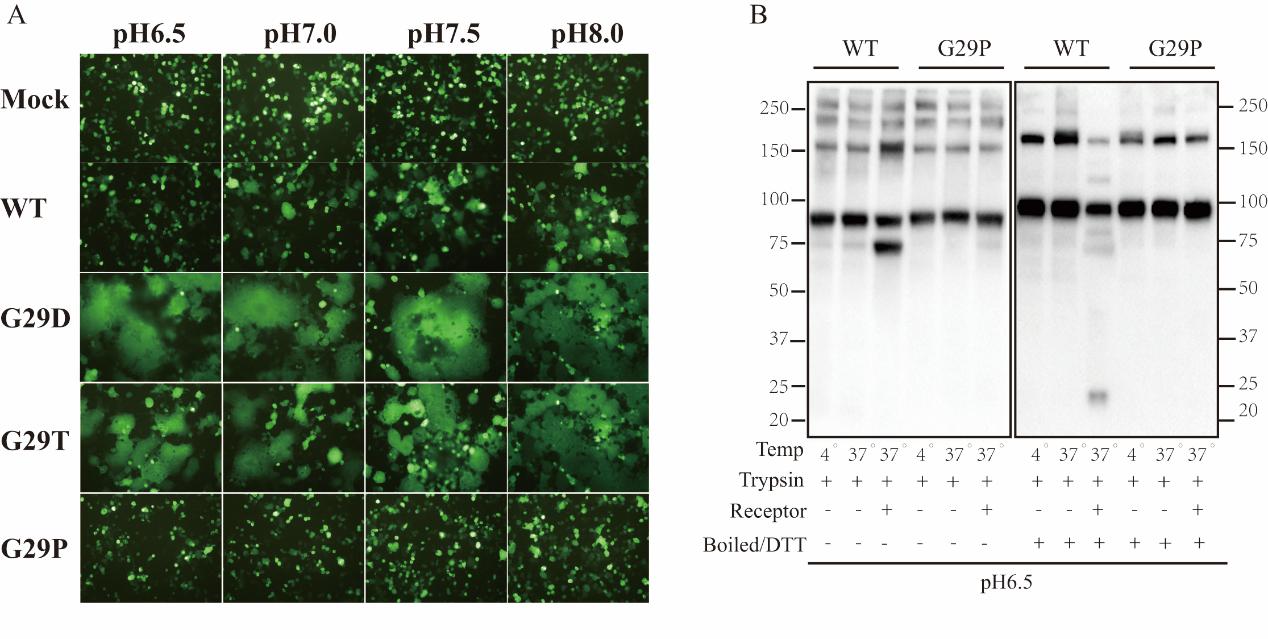
圖。G29突變體分析。(A)pH誘導的、不依賴于受體的細胞融合實驗;(B) 受體介導的S蛋白構象變化實驗。
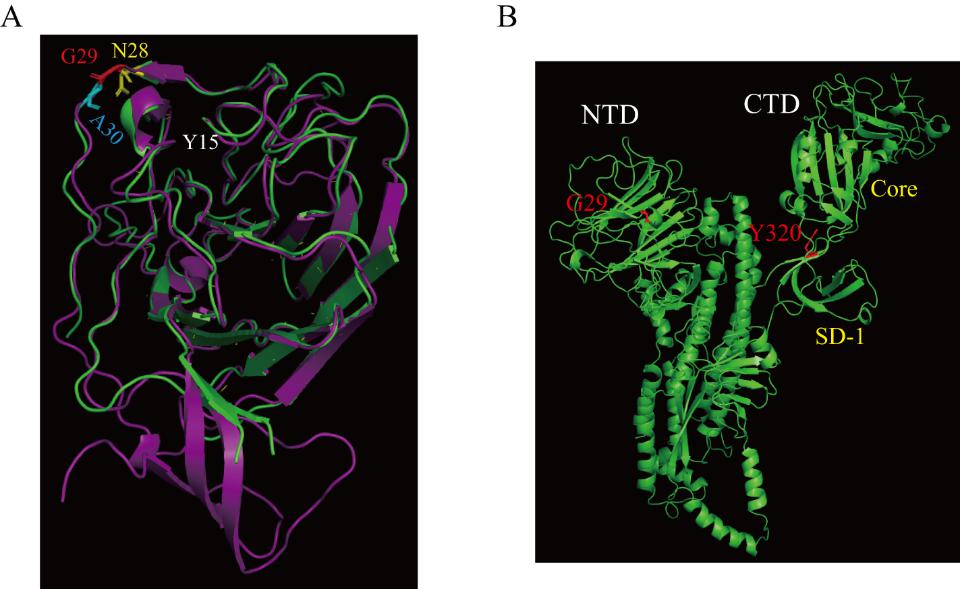
圖。MHV S蛋白結構。(A) NTD;(B) S蛋白單體
